解读干细胞三大机制:(二)旁分泌(转)
发布时间:2020-04-22 13:58:51 作者: 深圳市细胞治疗技术协会
随着新冠肺炎的全球蔓延,以干细胞为主的一系列科技攻关项目受到社会各界广泛关注,干细胞技术在这次疫情中展示了优秀疗效,并得到国家和政府的大力支持。
本系列撰文《干细胞的三大机制》将为大家解读干细胞对抗疾病的背后机理,看干细胞如何运用它的多向分化、旁分泌、归巢性三大机制来对抗疾病,发挥更有效的临床应用,让我们一起探索干细胞的背后秘密。
如果说,“干细胞变成什么,从而达到治疗效果”是干细胞的多向分化机制在发挥作用,那“干细胞释放什么,从而达到治疗效果”就对应了干细胞另一个重要机制——旁分泌(Paracrine)。
神奇的旁分泌机制,让干细胞如同身体里的“分布式发电站”,在适宜的时机,适宜的地点,将各种类型的因子,以发散的模式向外运输,发挥干细胞的积极功能。例如:
干细胞分泌VEGF,能够促进血管的新生,重塑血管;
干细胞分泌IL-6,能够调节免疫平衡,抑制炎症;
干细胞分泌SDF,能够抑制细胞的凋亡,保持年轻状态;
干细胞分泌FGF,促进成纤维细胞新生,改善肌肤状态。
接下来,让我们一起了解:旁分泌能分泌哪些因子,又分别能做什么?旁分泌机制能够帮助干细胞在哪些疾病里起到辅助作用?如何达到最佳的旁分泌效果?以及与旁分泌有关的诺贝尔奖技术——外泌体(exosome)?干细胞的旁分泌效应,能够表达、合成、分泌各类生长因子、细胞因子、调节因子、信号肽等多种生物活性分子,调节代谢、免疫、细胞分化、增殖、迁移、营养、凋亡等活性因子,并通过这些因子平衡了机体的内稳态,为干细胞免疫调节、抗凋亡等提供了适宜的环境。按照各个生物活性因子的主要功能分类,可以分为如下4种类型,如下表1总结所示[1]。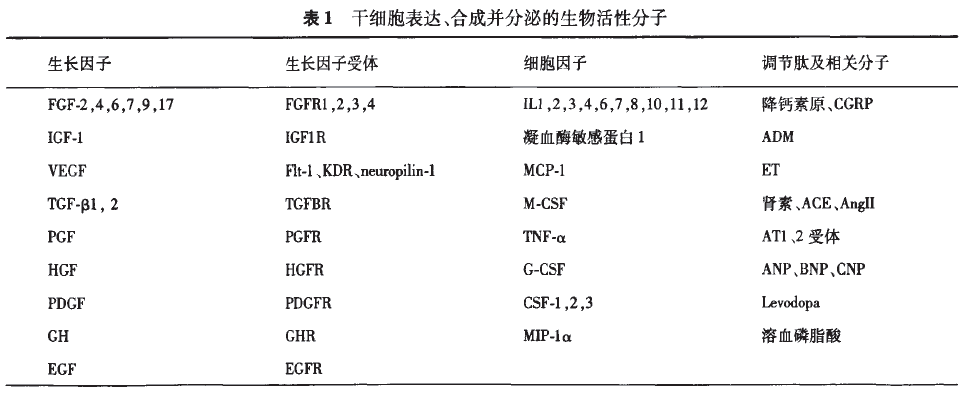
干细胞可以分泌促血管生成素1/2(angiopoietin-1/2,Ang 1/2),血管内皮生长因子(vascular endothelial growth factor,VEGF),胎盘生长因子(placental growth factor,PGF),成纤维细胞生长因子(fibroblast growth factor,FGF),血小板生长因子(platelet derived growth factor,PDGF),表皮生长因子(epidermal growth factor,EGF),转化生长因子(transforming growth factor-b,TGF-b),胰岛素样生长因子(insulin-like growth factor,IGF),生长激素(growth hormone,GH)和肝细胞生长因子(hepatocyte growth factor,HGF)等在内的多种生长因子。上述干细胞分泌的生长因子能够主要参与调节细胞繁殖、支持、存活、迁移、分化等多种细胞反应,为组织再生和器官修复提供适宜的微环境。
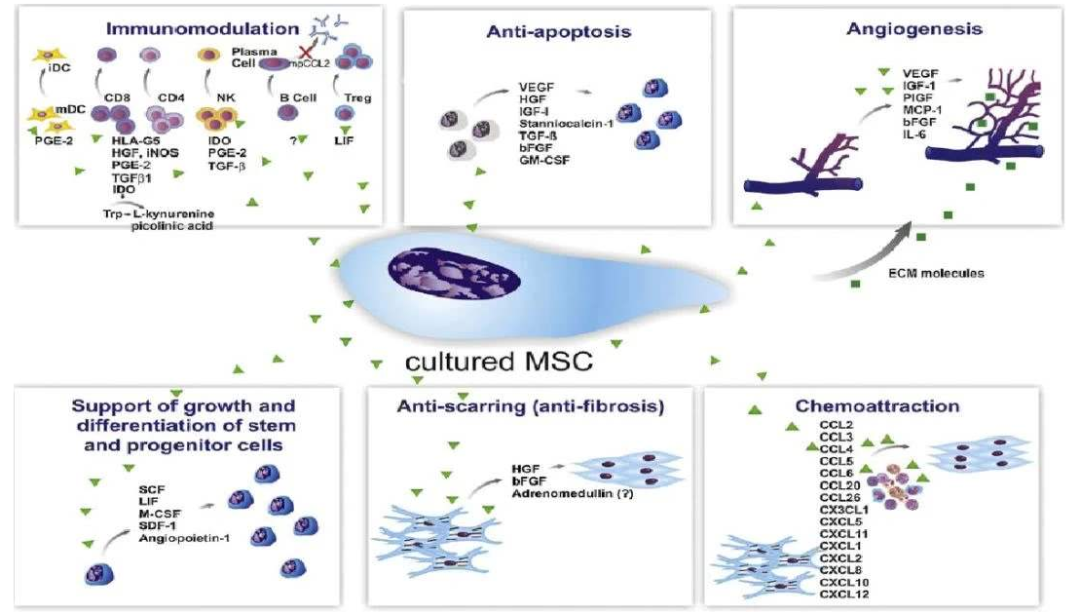
如VEGF、FGF、Ang1/2、HGF、PGF、PDGF和TGF-b等参与血管生成,促进血管内皮和平滑肌细胞的增殖和迁移,并促进缺血性血流恢复和血管重塑。IGF、VEGF、HGF等具有抗血管内皮、心肌、肾小管和肝细胞凋亡的作用。HGF除了抗凋亡外,还能促进有丝分裂并通过抑制TGF-b表达抗纤维化。IGF还可以通过PI3K信号通路增强心肌细胞收缩性等。
干细胞能够产生白介素家族(interleukin,IL),包括IL-1、IL-2、IL-3、IL-4、IL-6、IL-7、IL-8、IL-10、IL-11、IL-12等,肿瘤坏死因子家族(tumor necrosis factor,TNF),包括TNF-a,和趋化因子,包括巨噬细胞炎症蛋白(MIP-1a)、单核细胞化学趋化蛋白(MCP-1)等多种细胞因子,以及一些细胞因子的受体(配体)。
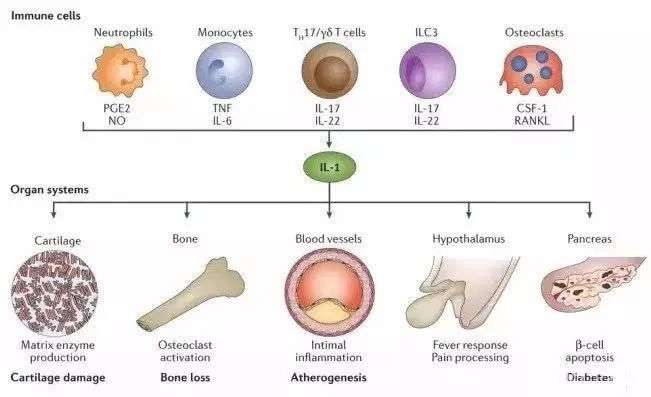
上述干细胞分泌的细胞因子能够主要参与调节代谢、炎症、细胞凋亡、防御等过程。
干细胞合成并分泌包括钠尿肽(natriuretic peptides,NP),包括C型利钠肽(CNP)、脑钠素(BNP)和心钠素(ANP)及其特异性受体等,降钙素基因相关肽(calcitonin gene-related peptide,CGPR),肾素-血管紧张素系统,内皮素(endothelin,ET)和肾上腺髓质素(adrenomedullin,ADM)等在内的多种调节肽。
上述干细胞分泌的调节肽能够主要参与涉及细胞存活与保护、心血管调节等过程,也为组织再生和器官修复提供稳定的内环境,是当前生理功能调节研究中的热门。
干细胞还产生一些特异性活性因子,不仅调节干细胞自身的存活、迁移、归巢和增殖等过程,还调节靶组织的功能与修复。这些因子包括,干细胞因子(stem cell factor,SCF),干细胞衍生因子(stem cell derived factor,SDF),干细胞衍生的神经干细胞支持因子(stem cell derived neural stem cell supporting factor,SDNSF)等。
其中,SCF是一种可溶性的生长因子,通过活化c-kit酪氨酸激酶受体发挥抗细胞凋亡作用。SDF是G蛋白偶联受体CXCR4的配体,干细胞不仅分泌SDF,还表达CXCR4,两者配合通过SDF/CXCR4信号通路抑制干细胞凋亡,并在干细胞归巢中发挥重要作用。
干细胞分泌的生物活性物质主要参与免疫调节和抗凋亡的过程,但同时有越来越多的证据表明干细胞分泌的因子,对组织再生和器官修复及其保护作用至少部分也有重要的功能。干细胞的旁分泌效应,影响了血管细胞的增殖、迁移、粘附和细胞外基质的形成等多个血管生成的环节。小鼠尾静脉注射干细胞,可以分泌因子,募集内皮细胞至小鼠后肢缺血区,促进血管生成,明显改善缺血后肢的状况。进一步研究发现,注射干细胞后可以上调FGF和VEGF的表达,增加血管数目,减轻肌肉萎缩及纤维化[2]。

△ 源自骨髓的基质细胞表达编码多种动脉生成细胞因子的基因,并通过旁分泌机制促进体外和体内动脉生成
干细胞的旁分泌效应,参与了肾脏保护。静脉注射干细胞的培养液,可以减轻肾小球细胞凋亡和肾脏损伤,提高存活率,提示干细胞可以通过其分泌功能减轻急性肾脏损伤[3]。
干细胞分泌的SDF可以通过和CXCR4配合,参与心肌保护。在体外,干细胞分泌的VEGF、IL-1、FGF、PDGF、IGF和TGF-b可以抑制成年心肌细胞凋亡并改善其收缩性[4]。静脉注射干细胞培养液能明显减轻D-半乳糖胺所导致的肝细胞空泡变性、坏死和凋亡以及白细胞浸润和组织结构变形等,提高爆发性肝衰小鼠的存活率,提示干细胞可以通过分泌功能治疗爆发性肝衰竭,保护肝脏[5]。

静脉注射干细胞可以通过分泌BNP,减轻水肿而明显减轻脑缺血后神经功能障碍。体外将间充质干细胞和海马组织共孵育,可以减轻氧和葡萄糖缺乏所致的神经细胞死亡和脑部微结构损伤,实现对神经系统的保护[6]。由此看出,干细胞的分泌功能会影响干细胞所在组织器官的结构、功能及其病理状态下的修复,是干细胞改善靶器官功能、抗凋亡、抗炎等疗效的重要机制之一。干细胞在运用具体机制,发挥各种作用的时候,并不是一个静止的过程,而是处于复杂的人体环境之中,会受所处的微环境、性别、年龄,其他生长因子、激素等诸多因素调节,而这些都会影响旁分泌达到最佳效果。

△ 微环境对间充质干细胞旁分泌信号传导的影响:设计治疗效果的机会
比如缺血、缺氧。缺氧会刺激干细胞分泌血管内皮生长因子,抑制成骨功能。缺血会刺激干细胞分泌血管内皮生长因子、神经细胞生长因子和肝细胞生长因子。
比如性别、年龄。性别可以影响干细胞的分泌功能强弱,分离自雌性、雄性小鼠的干细胞虽然都可以被脂多糖活化,但雌性干细胞被脂多糖活化后VEGF分泌上调得更明显。雄性干细胞被脂多糖影响而使得TNF-a的分泌抑制更明显。
年轻来源的干细胞被刺激后,相关基因的上调明显高于老龄组,而这些正是围产组织干细胞效果卓越的核心因素。当然,干细胞还能够结合基因编辑技术。如转录因子E2F1是调节间充质干细胞旁分泌机制的重要靶点,敲除E2F1能够上调间充质干细胞旁分泌细胞因子中的VEGF和TGF-b的表达,促进成纤维细胞的增殖和迁移,促进内皮细胞成管。敲除E2F1的间充质干细胞能够更好地促进小鼠创面血管化和胶原沉积,加快创面愈合。干细胞的旁分泌效应其实是一个大的概念,都属于干细胞的分泌组,如下图所示[7],分泌组包含三部分:旁分泌(小于10 nm),外泌体(40-120 nm)和微囊泡(200-1000 nm)。
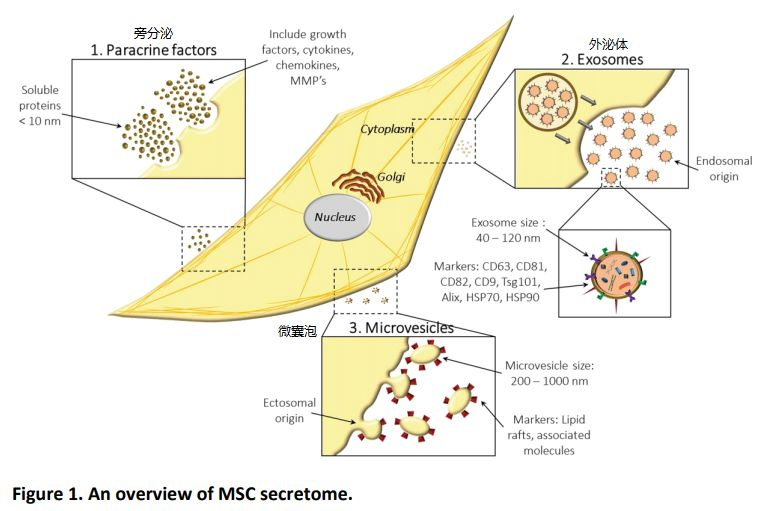
一般情况下,我们聊到干细胞的旁分泌效应,指的就是干细胞的分泌组,即干细胞可以依据生物活性因子的大小,匹配合适的分泌方式,直到1983年,干细胞分泌组中的外泌体突然C位出道,备受瞩目。1983年,外泌体首次于绵羊网织红细胞中被发现,1987年,Johnstone将其命名为"exosome"。起源于细胞内吞过程中形成的内体,最后再从细胞中释放到胞外,是一类直径40-120nm,具有完整膜结构的细胞外囊泡,富含RNA和蛋白质,主要负责细胞间的物质运输和信息传递。
同作为细胞间的一种通讯方式,只是相比于扩散的方式,外泌体更像一对一“同城闪送”,装着miRNA,mRNA和lncRNA,还有细胞因子等,或许还有点DNA,分泌出细胞外,再接着进入另一个细胞,交货完成订单。外泌体的C位出道,一方面是因为外泌体临床应用非常多,比如用于肿瘤诊断和治疗,作为药物的良好载体等等。当然,这些应用也只是外泌体应用的冰山之一角。
另一方面是随着干细胞体外培养技术的推广,干细胞外泌体作为高科技概念产品能够迅速在美容养颜领域风靡,引来全球注目。
综上所述,干细胞是广泛存在于机体各种组织的,具有多项分化和旁分泌机制的细胞体系,其旁分泌效应能够产生多种生长因子、细胞因子、调节肽以及干细胞特异性归巢和营养因子等生物活性因子,所分泌的上述物质能够在局部形成复杂的生物活性因子网络,并受缺血、缺氧、性别和年龄等影响,发挥最佳的效果,促进体内微环境的稳定,为干细胞组织再生、器官修复、免疫调节、抗凋亡等提供了适宜的环境。(本文来源:华夏源干细胞)[1]刘秀华,唐朝枢。干细胞的旁分泌和自分泌功能[J]。生理科学进展,2008, 39(3):196-202.[2]Kinnaird T, Stabile E, Burnett MS, et al. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms[J]. Circ Res, 2004, 94:678-685.[3]Togel F, Hu Z, Weiss K, et al. Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiation-independent mechanisms[J]. Am J Physiol Renal Physiol, 2005, 289:31-42.[4]Zhang M, Mal N, Kiedrowski M, et al. SDF-1 expression by mesenchymal stem cells results in trophic support of cardiac myocytes after myocardial infarction[J]. FASEB J, 2007, 42:441-448.[5]Parekkadan B, van Poll D, Suganuma K, et al. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure[J]. PLos ONE, 2007, 2:e941.[7]Gina D Kusuma1, James Carthew, etc. Effect of the microenvironment on mesenchymal stem cells paracrine signalling: opportunities to engineer the therapeutic effect[J]. Stem Cells and Development, 2016, 349:1-42.








