随着新冠肺炎的全球蔓延,以干细胞为主的一系列科技攻关项目受到社会各界广泛关注,干细胞技术在这次疫情中展示了优秀疗效,并得到国家和政府的大力支持。
本系列撰文《干细胞的三大机制》将为大家解读干细胞对抗疾病的背后机理,看干细胞如何运用它的多向分化、旁分泌、归巢性三大机制来对抗疾病,发挥更有效的临床应用,让我们一起探索干细胞的背后秘密。
有很多朋友,一边支持干细胞这项生物科技翘楚,一边也会怀疑,“无论我身体哪里有毛病,是肝脏,关节,还是卵巢,为什么每次都是静脉回输干细胞?那这些通过静脉进入我身体的干细胞,真的在我体内发挥功能了吗?”
这些朋友的质疑并不少见,毕竟干细胞技术不仅先进,有时也确实透露着“神奇”。
无论是“骨髓移植”(造血干细胞移植),还是静脉回输间充质干细胞,干细胞在体内都需要运输,需要被调动到受伤的组织周围发挥功能。因此,干细胞需要一个帮它导航定位的“GPS”,而这种能力就是干细胞的“归巢效应”。
干细胞正确的“归巢”,即“不用外力刻意,就将干细胞送到它该去的地方”,干细胞自己可以找到自己的“家”,这就是我们说的“归巢”:干细胞在外周血溜达一圈之后,能够发现并驻足在干细胞微环境“niche”中安居乐业。
“归巢”这个词,一直以来都只是一个概念,绚烂而空洞。归巢,归哪里的巢?归受伤组织还是特定组织?归巢的具体机制是什么?归巢需要别人的帮助吗?
01
归巢的过程
终于,2018年11月20日,国际期刊《nature》以封面形式发表了震惊干细胞领域的关键研究结果,即干细胞“归巢”的全过程,并找到了影响干细胞归巢的关键因素,先导细胞[1]。

过去,很多对干细胞“归巢”的研究都是在体外做的,这样获得的结果只能是对生命过程的推断。而想要在真正活体内看到干细胞的归巢,则是一个十分艰难的过程。

幸运地是,科学家们找到了一个活体观察干细胞归巢的“窗口”:斑马鱼胚胎中的尾部造血组织CHT,一个功能类似人类胎儿肝脏的器官,是斑马鱼新生干细胞首先归巢的地方。
CHT长不过300微米,厚度只有80微米,正好可以被高分辨率的激光共聚焦扫描显微镜透彻观察。观察中,干细胞的归巢之路是这样的:斑马鱼胚胎中,在心脏泵出的血液冲刷下,干细胞在主动脉血管壁侧壁诞生了。它循着血液在体内流转,当它经过CHT时,这里的血管内皮细胞上有一种粘附分子,让高速奔流的干细胞降速,减速之后的干细胞来到血管的“三岔路口”,遇到在路口巡逻的“先导细胞”。
先导细胞是巨噬细胞的一种亚型,以前未被报道,带有血管细胞粘附分子VCAM-1,它就像魔术扣一样,对准干细胞身上的另一半魔术扣“ITGA4”结合,将干细胞带到附近的静脉微血管中,在需要干细胞的地方发挥功能。这就是干细胞“归巢”的全过程。
这篇论文,不仅仅清晰观察并描述了干细胞归巢的全过程,也揭示了干细胞归巢的具体机制,包括“先导细胞”如何参与这个过程的。
接下来,将图文并茂地介绍一下归巢的机制。
02
归巢的机制
具体来看,VLA-4整合素(包括a4(itga4)和b1(itgb1)两个亚基),是早期胚胎发育中最重要的干细胞表面标记,而在小鼠以及斑马鱼中,a4(itga4)亚基更是在胚胎肺造血系统中发挥重要作用,当抑制a4(itga4)亚基之后,会干扰干细胞归巢和驻足的过程。
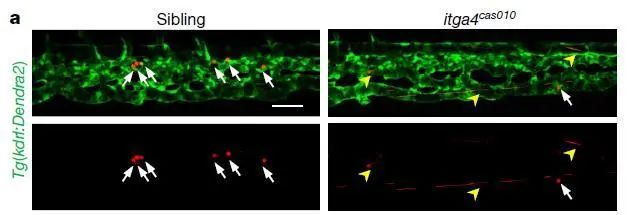
如上图a,左边为对照组,右边为抑制a4(itga4)亚基的斑马鱼,可以看出,对照组胚胎的干细胞能够很好得归巢以及驻足在“niche”(干细胞巢),停留时间长达30分钟。而当抑制a4(itga4)亚基之后,可以明显看到黄色箭头所指示的干细胞的“不断流动”,却很少驻足在白色箭头所示的“niche”中。
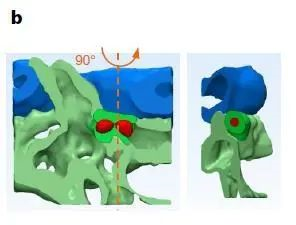
上图b是“niche”的3D示意图,当干细胞识别到此处是归巢地之后,干细胞会从血管内皮细胞中穿过,驻足在尾静脉毛细血管丛,避免被血液冲刷。
研究发现了干细胞归巢当中,在干细胞自身很重要的一个标签,ITGA4。这个标签就像是安装在干细胞身上的GPS,帮助干细胞纵观全局,掌握信息。当然,有了GPS还不够,干细胞还需要目的地的“引导”,才能够顺利移动,被带去需要干细胞的目的地。
接下来的实验证明了和ITGA4配对合作的另一个蛋白,VCAM-1。
发现VCAM-1+这个配对的“先导细胞”,是非常合理的,原因在于VCAM-1(血管细胞粘附分子-1)正是VLA-4的常见配体,而配体的概念就是“钥匙和孔”,和干细胞归巢中的“魔术扣”环环相扣,不谋而合,因此科学家自然快速想到来验证这一猜想。
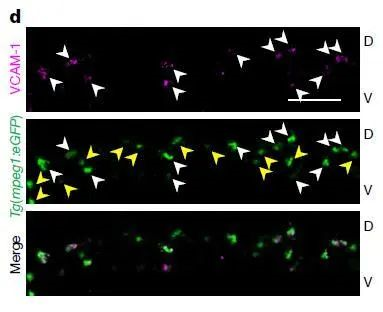
结果发现,如上图,绿色荧光标记了CHT中的巨噬细胞,洋红色荧光标记的是VCAM-1阳性的细胞。可以看到,白色箭头表明所有的VCAM-1+细胞都是CHT中的巨噬细胞,黄色箭头表明,不是所有CHT的巨噬细胞都是VCAM-1+细胞(大概只有45%是VCAM-1+),充分不必要条件。
这能得到一个很简单、客观的分析结果,CHT中的巨噬细胞,只有一部分是VCAM-1+细胞,这部分细胞存在的意义,和引导干细胞归巢密不可分。
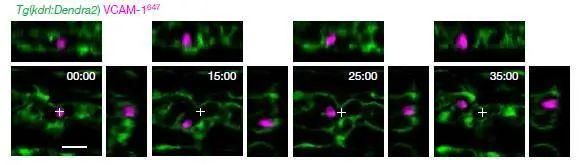
进一步,如上图所示,我们验证了这部分VCAM-1+巨噬细胞,在CHT中的活动和驻足情况,与干细胞在“niche”中的驻足情况一致,即VCAM-1+细胞和干细胞在相同的时间,以相同的路径,出现在相同的位置。
到这里,我们基本上可以确定VCAM-1+细胞就是干细胞归巢的“先导细胞”,依赖的是VCAM1-ITGA魔术扣的方式。
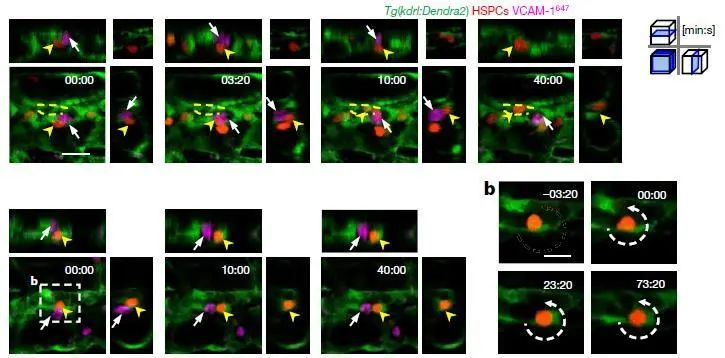
最后,通过活体同时观察100个干细胞和“先导细胞”VCAM-1+细胞的集群活动,如上图所示,我们可以看到,每一对干细胞和“先导细胞”都能平均保持30分钟左右的团体活动,以相同的运动轨迹一同滞留在CHT区域,等待安排。
在整个活体观察实验中,我们总共统计了长达48-60 hpf(斑马鱼受精后小时数)的干细胞“归巢”活动,并发现了与之协同配合的“先导细胞”的活动。虽然不清楚具体将干细胞引导至不同“niche”的机制,但干细胞受“引导细胞”指引,在奔腾的血流中驻足停留,在“niche”中等待进一步信号,是比较清晰的途径,这也是干细胞领域在活体层面证明了干细胞“归巢”的客观证据。
因此,在干细胞归巢机制的加持下,无论身体哪里出现了问题,都可以静脉注射,一次性方便、安全地将大量干细胞输送至身体损伤的部位,而不用担心刚输入就消失了。通过静脉输入的干细胞,也确实会在受损部位发挥积极的修复功能,这也在理论层次上正式解释了干细胞静脉输注的科学原理。
随着干细胞理论的日趋完善,干细胞实际操作会更加科学准确。(本文来源:华夏源干细胞)
参考文献:
[1]Dantong Li, etc. VCAM-1+ macrophages guide the homing of HSPCs to a vascular niche[J].nature,2018.